¡Buenos días a todos! Cada vez se acerca más la hora del juicio final! ja ja ja
Vayamos a ello:
Fuerza de ácidos y bases:
Un ácido es una solución que tiene un exceso de hidrógeno (H +) iones. Una base es una solución que tiene un exceso de hidróxido (OH-) los iones. Otra palabra para la base es alcalino. La fuerza de un ácido o base puede ser fuerte o débil.
*Un ácido que tiene un pH muy bajo (0-4) se conocen como ácidos fuertes.
*Una base que tiene un pH muy alto (10-14) se conocen como bases fuertes.
*Un ácido que se ioniza parcialmente en solución acuosa se conocen como ácidos débiles.
* Una base de que sólo se ioniza parcialmente en solución acuosa se conocen como bases débiles.
Bases son las sustancias (moleculares o iónicas) que pueden tomar iones H+
Son ácidos de Brönsted-Lowry:
* moléculas como: HCl, H2SO4, H3PO4, H2O...
* cationes como: NH4+,H3O+
* aniones como: HSO4-, H2PO4−, HS−
Como se aprecia en la lista, se amplía la gama de sustancias ácidas a otros compuestos
moleculares y sobre todo a especies iónicas.
Son bases de Brönsted-Lowry:
* moléculas como: NH3, H2O, CH3NH2...
* aniones como: I−, Cl−, SO42−, HPO42−, OH−
* cationes como: [Cu(H2O)3OH]+
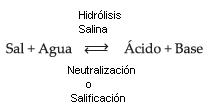
Hidrólisis de sales
Enlace al IES VALLECAS MAGERIT.Es una PDF muy útil con la explicación : http://ies.magerit.madrid.educa.madrid.org/fyqiesvm/bc2aquimica/hidrolisis_sales.pdf
No hay comentarios:
Publicar un comentario