Aun así os cuelgo enlaces de ejercicios de selectividad de nuestro profesor.(Resueltos)
Química Torre Almirante
En este Blog podrás encontrar toda la programación del curso en la asignatura de Química de 2º de Bachillerato del I.E.S Torre Almirante,así como curiosidades,ejercicios,vídeos y experimentos,todo relacionado con el maravilloso mundo de la ciencia. Si tienes alguna pregunta no dudes en exponerla.¡Podrás comentar aunque no estés registrado!
lunes, 6 de mayo de 2013
Semana del 29 de Abril al 5 de Mayo
Buenos días.Esta semana solo ha habido un día de clase, ya que había puente de miércoles a viernes.
lunes, 29 de abril de 2013
Semana del 22 al 28 de Abril
Hooooooooooooola chicos, hoy comenzamos un nuevo tema: Reacciones de oxidación y reducción.
La oxidación es un cambio químico en el que un átomo o grupo de átomos
pierden electrones o bien es la reacción en la que un átomo aumenta su
número de oxidación. La reducción es un cambio químico en el cual un
átomo o grupo de átomos ganan electrones, o también es la reacción en la que
un átomo disminuye su número de oxidación.
La oxidación y la reducción siempre ocurren simultáneamente ya que el
número de electrones perdidos en la oxidación debe ser igual al número de
electrones ganados en la reducción
Oxidante es la especie química que captando electrones (aumentando su carga
negativa o disminuyendo su carga positiva) consigue la oxidación de otra. Reductor es la especie química que cediendo electrones(aumentando su carga
positiva o disminuyendo su carga negativa) produce la reducción de otra.
El oxidante se reduce y el reductor se oxida por lo que las reacciones redox
transcurren entre pares conjugados de oxidación-reducción.
ESTADOS DE OXIDACIÓN
Se define número de oxidación o estado de oxidación de un elemento en un
compuesto, como la carga que tendría un átomo de ese elemento si el
compuesto del que forma parte estuviese constituido por iones.
Las reglas básicas para asignar estado de oxidación son las siguientes.
1. El número de oxidación de un elemento libre es cero, tanto si es
atómico como molecular (Fe, H 2 ,Cl2 etc.)
2. En los iones simples (iones de un solo átomo el # de oxidación = a la
carga del ión) por ejemplo Al+3 ,,Fe a veces tiene # de oxidación de +2
y +3
3. El hidrógeno y los elementos del grupo IA de la tabla periódica
tienen # de oxidación de +1 Ejem. H+1 , Li +1 , Na+1 , Rb+1 etc. El
hidrógeno trabaja con –1 en el caso de hidruros metálicos ejem. Na +1
H
-14. Los elementos del grupo IIA el # de oxidación es de +2 ejemplo Ca .
Mg++ , Sr ++ , Ba++ etc.
5. En la mayor parte de los compuestos que contienen oxígeno el # de
oxidación de este compusto es –2. Existen sus excepciones como en el
caso de los peróxidos que es –1 H2
O2 , en los superóxidos es –1/2 y en
sus combinaciones con el flúor es +2 y +1.
6. Los halógenos (F,-1 Cl-1, Br-1, I-1 ) cuando no están combinados con el
oxígeno tienen # de oxidación X-1
.
7. La suma algebraica de los números de oxidación de todos los átomos
que forman una molécula neutra es cero. Si se trata de un ión, la suma
es igual a la carga del ión.
BALANCEO DE REACCIONES REDOX POR EL MÉTODO DE
OXIDACIÓN-REDUCCIÓN
Este método se basa en que el aumento total en el número de oxidación de los
átomos que se oxidan ha de ser igual a la disminución total de los números de
oxidación de los átomos que se reducen, por tanto el número de electrones que
se ganan o se pierden debe ser el mismo. Los pasos a seguir son:
1. Escribir la ecuación completa colocando arriba de cada átomo, las
valencias con que están unidas.
2. Se separan los elementos oxidados y reducidos indicando el # de
electrones ganados o perdidos en cada caso. Para obtener el # de
electrones ganados o perdidos debemos balancear cada ecuación e
igualar cargas
3. El nº de electrones perdidos por el agente reductor debe ser igual al #
de electrones ganados por el agente oxidante. Por lo tanto se tiene que
igualar el nº de electrones ganados y perdidos.
4. Se procede a colocar los coeficientes en los sitios de la reacción
correspondiente
5. La ecuación aún no esta balanceada , se hacen los ajustes necesarios.
http://clasesdeapoyonuevo.s3.amazonaws.com/capitulos/soluciones/5.9.1.3.pdf
La oxidación es un cambio químico en el que un átomo o grupo de átomos
pierden electrones o bien es la reacción en la que un átomo aumenta su
número de oxidación. La reducción es un cambio químico en el cual un
átomo o grupo de átomos ganan electrones, o también es la reacción en la que
un átomo disminuye su número de oxidación.
La oxidación y la reducción siempre ocurren simultáneamente ya que el
número de electrones perdidos en la oxidación debe ser igual al número de
electrones ganados en la reducción
Oxidante es la especie química que captando electrones (aumentando su carga
negativa o disminuyendo su carga positiva) consigue la oxidación de otra. Reductor es la especie química que cediendo electrones(aumentando su carga
positiva o disminuyendo su carga negativa) produce la reducción de otra.
El oxidante se reduce y el reductor se oxida por lo que las reacciones redox
transcurren entre pares conjugados de oxidación-reducción.
ESTADOS DE OXIDACIÓN
Se define número de oxidación o estado de oxidación de un elemento en un
compuesto, como la carga que tendría un átomo de ese elemento si el
compuesto del que forma parte estuviese constituido por iones.
Las reglas básicas para asignar estado de oxidación son las siguientes.
1. El número de oxidación de un elemento libre es cero, tanto si es
atómico como molecular (Fe, H 2 ,Cl2 etc.)
2. En los iones simples (iones de un solo átomo el # de oxidación = a la
carga del ión) por ejemplo Al+3 ,,Fe a veces tiene # de oxidación de +2
y +3
3. El hidrógeno y los elementos del grupo IA de la tabla periódica
tienen # de oxidación de +1 Ejem. H+1 , Li +1 , Na+1 , Rb+1 etc. El
hidrógeno trabaja con –1 en el caso de hidruros metálicos ejem. Na +1
H
-14. Los elementos del grupo IIA el # de oxidación es de +2 ejemplo Ca .
Mg++ , Sr ++ , Ba++ etc.
5. En la mayor parte de los compuestos que contienen oxígeno el # de
oxidación de este compusto es –2. Existen sus excepciones como en el
caso de los peróxidos que es –1 H2
O2 , en los superóxidos es –1/2 y en
sus combinaciones con el flúor es +2 y +1.
6. Los halógenos (F,-1 Cl-1, Br-1, I-1 ) cuando no están combinados con el
oxígeno tienen # de oxidación X-1
.
7. La suma algebraica de los números de oxidación de todos los átomos
que forman una molécula neutra es cero. Si se trata de un ión, la suma
es igual a la carga del ión.
BALANCEO DE REACCIONES REDOX POR EL MÉTODO DE
OXIDACIÓN-REDUCCIÓN
Este método se basa en que el aumento total en el número de oxidación de los
átomos que se oxidan ha de ser igual a la disminución total de los números de
oxidación de los átomos que se reducen, por tanto el número de electrones que
se ganan o se pierden debe ser el mismo. Los pasos a seguir son:
1. Escribir la ecuación completa colocando arriba de cada átomo, las
valencias con que están unidas.
2. Se separan los elementos oxidados y reducidos indicando el # de
electrones ganados o perdidos en cada caso. Para obtener el # de
electrones ganados o perdidos debemos balancear cada ecuación e
igualar cargas
3. El nº de electrones perdidos por el agente reductor debe ser igual al #
de electrones ganados por el agente oxidante. Por lo tanto se tiene que
igualar el nº de electrones ganados y perdidos.
4. Se procede a colocar los coeficientes en los sitios de la reacción
correspondiente
5. La ecuación aún no esta balanceada , se hacen los ajustes necesarios.
http://clasesdeapoyonuevo.s3.amazonaws.com/capitulos/soluciones/5.9.1.3.pdf
lunes, 22 de abril de 2013
Semana del 15 al 21 de Abril
¡Buenos días a todos! Cada vez se acerca más la hora del juicio final! ja ja ja
Vayamos a ello:
Fuerza de ácidos y bases:
Un ácido es una solución que tiene un exceso de hidrógeno (H +) iones. Una base es una solución que tiene un exceso de hidróxido (OH-) los iones. Otra palabra para la base es alcalino. La fuerza de un ácido o base puede ser fuerte o débil.
*Un ácido que tiene un pH muy bajo (0-4) se conocen como ácidos fuertes.
*Una base que tiene un pH muy alto (10-14) se conocen como bases fuertes.
*Un ácido que se ioniza parcialmente en solución acuosa se conocen como ácidos débiles.
* Una base de que sólo se ioniza parcialmente en solución acuosa se conocen como bases débiles.
Bases son las sustancias (moleculares o iónicas) que pueden tomar iones H+
Son ácidos de Brönsted-Lowry:
* moléculas como: HCl, H2SO4, H3PO4, H2O...
* cationes como: NH4+,H3O+
* aniones como: HSO4-, H2PO4−, HS−
Como se aprecia en la lista, se amplía la gama de sustancias ácidas a otros compuestos
moleculares y sobre todo a especies iónicas.
Son bases de Brönsted-Lowry:
* moléculas como: NH3, H2O, CH3NH2...
* aniones como: I−, Cl−, SO42−, HPO42−, OH−
* cationes como: [Cu(H2O)3OH]+
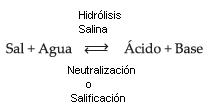
Hidrólisis de sales
Enlace al IES VALLECAS MAGERIT.Es una PDF muy útil con la explicación : http://ies.magerit.madrid.educa.madrid.org/fyqiesvm/bc2aquimica/hidrolisis_sales.pdf
Vayamos a ello:
Fuerza de ácidos y bases:
Un ácido es una solución que tiene un exceso de hidrógeno (H +) iones. Una base es una solución que tiene un exceso de hidróxido (OH-) los iones. Otra palabra para la base es alcalino. La fuerza de un ácido o base puede ser fuerte o débil.
*Un ácido que tiene un pH muy bajo (0-4) se conocen como ácidos fuertes.
*Una base que tiene un pH muy alto (10-14) se conocen como bases fuertes.
*Un ácido que se ioniza parcialmente en solución acuosa se conocen como ácidos débiles.
* Una base de que sólo se ioniza parcialmente en solución acuosa se conocen como bases débiles.
Bases son las sustancias (moleculares o iónicas) que pueden tomar iones H+
Son ácidos de Brönsted-Lowry:
* moléculas como: HCl, H2SO4, H3PO4, H2O...
* cationes como: NH4+,H3O+
* aniones como: HSO4-, H2PO4−, HS−
Como se aprecia en la lista, se amplía la gama de sustancias ácidas a otros compuestos
moleculares y sobre todo a especies iónicas.
Son bases de Brönsted-Lowry:
* moléculas como: NH3, H2O, CH3NH2...
* aniones como: I−, Cl−, SO42−, HPO42−, OH−
* cationes como: [Cu(H2O)3OH]+
Hidrólisis de sales
Enlace al IES VALLECAS MAGERIT.Es una PDF muy útil con la explicación : http://ies.magerit.madrid.educa.madrid.org/fyqiesvm/bc2aquimica/hidrolisis_sales.pdf
lunes, 15 de abril de 2013
Semana del 8 al 14 Abril
Hola,buenos días.Debido a problemas personales las publicaciones en el blog se han atrasado mas de lo que debieran..Perdonen las molestias.
Teoría de ácidos y bases de Brönsted-Lowry
En química , la teoría de Brönsted-Lowry es una teoría ácido-base, propuesta independientemente por el danés Johannes Nicolaus Bronsted y el británico Thomas Martin Lowry en 1923
En este sistema, ácidos de Brønsted y bases de Brønsted se definen, por
el cual un ácido es una molécula o ion que es capaz de bajar, o
"donar", un hidrógeno catiónico (proton, H+), y una base de una especie con la capacidad para ganar, o "aceptar", un catión de hidrógeno (protones)
Sustancias anfóteras
Son aquellos compuestos que son capaces de comportarse como un ácido o una base,dependiendo con que otros compuestos se mezclen.La teoría de Brönsted-Lowry justifica este curioso fenómeno.
Un ejemplo de sustancia anfótera es el ión [HCO3]-
*En comparación,la teoría B-L es mucho más completa que la teoría de Arrhenius,ya que las nuevas definiciones son aplicables a cualquier disolvente y no solo a disoluciones acuosas.
La definición de base presenta notables diferencias con respecto a la definión de Arrhenius y permite dar una explicación a la existencia de sustancias anfóteras.
Propiedades ácido-base del agua
PROPIEDADES ÁCIDO-BASE DEL AGUA
El agua, según la teoría de Bronsted, es un ácido y una base (ANFÓTERO).
En la práctica se ha mostrado que el agua pura está ligeramente
ionizada y produce igual número de iones hidrógeno que de iones
hidróxido:
H2O + H2O = H3O+ + OH-
O en una notación simplificada:
H2O = H+ (ac) + OH- (ac)
Podemos deducir que el agua pura destilada es neutra en cuanto a su acidez y basicidad, pero que en contacto con otros elementos tendrá ya sea predominio ácido o básico.
H2O + H2O = H3O+ + OH-
O en una notación simplificada:
H2O = H+ (ac) + OH- (ac)
Podemos deducir que el agua pura destilada es neutra en cuanto a su acidez y basicidad, pero que en contacto con otros elementos tendrá ya sea predominio ácido o básico.
El agua es un disolvente único. Una de sus propiedades especiales es su capacidad para actuar como un ácido o como una base.
El agua se comporta como una base en reacciones con ácidos como el Hcl y como un ácido con bases como el NH2. El agua es un mal conductor de electricidad ya que es un electrolito muy débil, pero experimenta una ligera ionización.
H2Ol ↔ H2 (h2) +OH- (0-1)
A esta ecuación en ocasiones se le conoce como auto-ionización del agua.
Según Bronsted, en su esquema se expresa la auto-ionización del agua como sigue:
H – O: + H – O: ↔ H – O – H +
+ H – O:
H H H
H2O + H2O ↔ H3O+ + O+]-
Acido 1 base 2 acido2 base 1
En disoluciones acuosas la concentración del Ion de hidrógeno es muy importante, ya que indica la acidez o basicidad de la disolución.
Sólo una pequeña parte de las moléculas del agua se ioniza, por los que permanece casi sin cambio la concentración del agua.
El agua se comporta como una base en reacciones con ácidos como el Hcl y como un ácido con bases como el NH2. El agua es un mal conductor de electricidad ya que es un electrolito muy débil, pero experimenta una ligera ionización.
H2Ol ↔ H2 (h2) +OH- (0-1)
A esta ecuación en ocasiones se le conoce como auto-ionización del agua.
Según Bronsted, en su esquema se expresa la auto-ionización del agua como sigue:
H – O: + H – O: ↔ H – O – H +
+ H – O:
H H H
H2O + H2O ↔ H3O+ + O+]-
Acido 1 base 2 acido2 base 1
En disoluciones acuosas la concentración del Ion de hidrógeno es muy importante, ya que indica la acidez o basicidad de la disolución.
Sólo una pequeña parte de las moléculas del agua se ioniza, por los que permanece casi sin cambio la concentración del agua.
Concepto de PH
 Del producto iónico del agua se deduce
que las concentraciones de H+ y OH- están relacionadas
de tal modo que conocida una de ellas se obtiene la otra de forma inmediata
Del producto iónico del agua se deduce
que las concentraciones de H+ y OH- están relacionadas
de tal modo que conocida una de ellas se obtiene la otra de forma inmediata
Para simplificar el manejo de magnitudes
exponenciales se ha establecido el concepto de pH. pH
es el logaritmo de la concentración de iones H+,
con el signo cambiado:
Análogamente, se define pOH
como el logaritmo de la concentración de iones OH-, con
el signo cambiado:
Se puede establecer la siguiente relación entre
el pH y el pOH. Partiendo de la expresión del producto iónico
del agua (Kw):
tomando logaritmos:
y cambiando de signos se obtiene que:
o, lo que es lo mismo,

lunes, 8 de abril de 2013
Semana del 1 al 7 de Abril
Buenos días a todos y todas.He de destacar que hoy es el cumpleaños de la creadora de esta página.Tenía la necesidad de publicarlo....
Esta semana anterior hemos estado repasando ya que hoy tenemos por la tarde a las 16:30 la recuperación del 2º trimestre. ¡Suerte a todos!
También hemos comenzado tema nuevo, llamado "Ácidos y bases". En este tema estudiaremos uno de los conceptos más importantes en química que es el término "acidez".Los ácidos y bases son dos tipos de compuestos químicos que presentan características
opuestas. Su existencia se conoce desde antiguamente, cuando su
diferenciación se efectuaba por el procedimiento de
comprobar su sabor: los ácidos suelen ser agrios mientras que las bases
presentan apariencia jabonosa.Este tipo de prueba puede resultar peligrosa, ya que se puede llegar incluso a la muerte debido a la toxicidad que produce en el cuerpo humano algunos compuestos.
La pregunta 1, llamada ideas previas sobre electrolitos ácidos y bases nos da una idea preparatoria para introducirnos en el tema:
-Las disoluciones acuosas (soluto y disolvente) son mezclas homogéneas de extraordinario interés.Los solutos que se disuelven en agua se clasifican en electrolitos y no electrolitos.El primero es una sustancia que al disolverse en agua experimenta una disociacón o ionización total o parcial en sus iones.Por el contrario, aquellas sustancias que no se disocian en iones son denominadas no electrolitos
lunes, 1 de abril de 2013
Última semana del 2º trimestre 18/22 Marzo
Buenos días a todos.Tras una buena semana Santa para recargar energías (aunque nos hubiese gustado tener unos cuantos días más) volvemos a clase para afrontar el 3º trimestre, el último y más duro.
La semana antes de las vacaciones, como siempre, hubo una gran bajada de alumnos que se quedan en sus respectivos hogares, ya que normalmente la última semana se suele hacer poco...
Nuestro querido profesor Paco, esta semana ha estado explicando problemas de precipitados, que entra dentro del tema que estábamos tratando (Tema 8-Equilibrios)
Las reacciones de precipitación como ejemplos de equilibrios heterogéneos. Solubilidad y producto de solubilidad.
Estudio cualitativo de la disolución de precipitados.
Aplicaciones analíticas de las reacciones de precipitación.
Son reacciones de equilibrio heterogéneo sólido-líquido.
-La fase sólida contiene una sustancia poco soluble (normalmente una sal)
-La fase líquida contiene los iones producidos en la disociación de la sustancia sólida.
-Normalmente el disolvente suele ser agua.
Ejemplo de problema:
Se dispone de una disolución acuosa saturada de 3 Fe(OH) , compuesto poco soluble.
a) Escriba la expresión del producto de solubilidad para este compuesto.
b) Deduzca la expresión que permite conocer la solubilidad del hidróxido a partir del producto
de solubilidad.
c) Razone cómo varía la solubilidad del hidróxido al aumentar el pH de la disolución.
QUÍMICA. 2010. JUNIO. EJERCICIO 3. OPCIÓN A
a) Escriba la expresión del producto de solubilidad para este compuesto.
b) Deduzca la expresión que permite conocer la solubilidad del hidróxido a partir del producto
de solubilidad.
c) Razone cómo varía la solubilidad del hidróxido al aumentar el pH de la disolución.
QUÍMICA. 2010. JUNIO. EJERCICIO 3. OPCIÓN A
a) El equilibrio de solubilidad es: 3
3 Fe(OH) (s) Fe + (ac) + 3OH− (ac) . La expresión del
producto de solubilidad es:
3 Fe(OH) (s) Fe + (ac) + 3OH− (ac) . La expresión del
producto de solubilidad es:
Ks = ⎡⎣Fe3+ + (ac)⎤⎦ ⋅ ⎡⎣OH− (ac)⎤⎦3
b) Llamamos solubilidad a la concentración de compuesto disuelto en una disolución que está en
equilibrio con el sólido, por lo tanto:
⎡Fe3+ (ac)⎤ = s ⎣ ⎦
⎡⎣OH− (ac)⎤⎦ = 3s
equilibrio con el sólido, por lo tanto:
⎡Fe3+ (ac)⎤ = s ⎣ ⎦
⎡⎣OH− (ac)⎤⎦ = 3s
c) Al aumentar el pH de la disolución disminuye la concentración de iones 3 H O+ y aumenta la
concentración de ionesOH− . Según el principio de Le Chatelier, el equilibrio se desplazará hacia la
izquierda para compensar el aumento de concentración de iones OH− , con lo cual disminuye la
solubilidad del compuesto.
concentración de ionesOH− . Según el principio de Le Chatelier, el equilibrio se desplazará hacia la
izquierda para compensar el aumento de concentración de iones OH− , con lo cual disminuye la
solubilidad del compuesto.
Suscribirse a:
Comentarios (Atom)